近年来重度雾霾的原因之一、在汽车排气管中安装催化净化装置可以一定程度上减少对环境的伤害,其反应原理为2CO(g)+2NO(g)

N
2(g)+2CO
2(g)
∆H=-744kJ/mol。一定温度下,向aL恒容密闭容器中充入2 mol CO和2 mol NO模拟汽车尾气的净化,测得CO、CO
2的物质的量浓度随时间变化如图所示。

回答下列问题:
(1)写出N
2的电子式
_______。
(2)E点时n(CO
2)=
_______。
(3)0~5min这段时间内用NO表示的平均反应速率为v(NO)=
_______,图中表明反应处于平衡状态的点是
_______(填“E”或“F”)。
(4)为研究汽车尾气转化为无毒无害物质的有关反应,在密闭容器中充入10 mol CO和8 mol NO发生反应,如图所示为平衡时NO的体积分数与温度、压强的关系。

回答下列问题:
①该反应达平衡后,为了在提高反应速率同时提高NO的转化率,可采取的措施
_______(填字母代号)。
a.改用高效催化剂
b.升高温度
c.缩小容器的体积 d.增加CO的浓度
②压强为10MPa、温度为T
1下,若反应进行到10 min达到平衡状态,请计算该温度下平衡常Kp=
_______(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的
_______点。
 溶液中逐滴加入
溶液中逐滴加入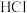 ,以X表示
,以X表示 或
或 。已知
。已知 ,混合溶液
,混合溶液 与
与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 与
与 的关系
的关系 第一步电离常数的数量级为
第一步电离常数的数量级为
 时,
时,
 时,
时,
 M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:



 ]、水碳比[M=
]、水碳比[M= ]的关系如图2和图3所示,回答下列问题:
]的关系如图2和图3所示,回答下列问题:
 2NH3(g)+CO2(g)。某实验在恒容条件下,发生上述反应,根据实验测得数据绘制图像如图:
2NH3(g)+CO2(g)。某实验在恒容条件下,发生上述反应,根据实验测得数据绘制图像如图:
 +C(C为常数)。根据图4计算该反应△H=
+C(C为常数)。根据图4计算该反应△H= N2(g)+2CO2(g) ∆H=-744kJ/mol。一定温度下,向aL恒容密闭容器中充入2 mol CO和2 mol NO模拟汽车尾气的净化,测得CO、CO2的物质的量浓度随时间变化如图所示。
N2(g)+2CO2(g) ∆H=-744kJ/mol。一定温度下,向aL恒容密闭容器中充入2 mol CO和2 mol NO模拟汽车尾气的净化,测得CO、CO2的物质的量浓度随时间变化如图所示。

 )、c(NH3·H2O)四种微粒pX与pH关系如下图所示[pX=-lgc(X)]。
)、c(NH3·H2O)四种微粒pX与pH关系如下图所示[pX=-lgc(X)]。
 )
)


