
 )的关系如图所示。
)的关系如图所示。
 =
= )是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
)是重要的锂电池正极材料,一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图。
| 物质 | FeS | MnS | CuS | PbS | ZnS |
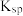 |  |  |  |  |  |
 ,其目的是①提供较强的酸性环境;②
,其目的是①提供较强的酸性环境;② 的离子方程式为
的离子方程式为 时视为沉淀完全,又知
时视为沉淀完全,又知 ,
, ,则要使滤液2中铁离子沉淀完全且不生成
,则要使滤液2中铁离子沉淀完全且不生成 沉淀,应控制pH
沉淀,应控制pH ,
, ]。
]。 的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时,
的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时, 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则x=
,结构示意图如(b)所示,则x=


 (含
(含 溶液)反应的化学方程式:
溶液)反应的化学方程式: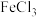 溶液发生显色反应且含四个甲基,则W的结构共有
溶液发生显色反应且含四个甲基,则W的结构共有 )是一种缓释型解热镇痛药。实验室由A和B制备M的一种合成路线如图所示:
)是一种缓释型解热镇痛药。实验室由A和B制备M的一种合成路线如图所示:
 ;
; ;
; 。
。
 内循环。工艺流程如图:
内循环。工艺流程如图:
 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为 为沉淀完全;
为沉淀完全; :
: )
)  )是机体生长发育过程中不可缺少的一种微量元素,它具有抗氧化,抗衰老和提高免疫力的作用。硒的化合物在生产、生活中由广泛的应用。回答下列问题:
)是机体生长发育过程中不可缺少的一种微量元素,它具有抗氧化,抗衰老和提高免疫力的作用。硒的化合物在生产、生活中由广泛的应用。回答下列问题: 的空间构型是
的空间构型是
 )后可增加抗癌活性,甲硒醇的熔沸点低于甲醇,原因是
)后可增加抗癌活性,甲硒醇的熔沸点低于甲醇,原因是 的晶体结构如下图所示,其晶胞参数为
的晶体结构如下图所示,其晶胞参数为 ,阿伏伽德罗常数值为
,阿伏伽德罗常数值为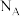 。M原子的分数坐标为
。M原子的分数坐标为 的晶胞密度为
的晶胞密度为 (列出计算式)。
(列出计算式)。
| H2C2O4 | Co2+ | Cl- | |
| 质量浓度 | 20.0g/L | 1.18g/L | 2.13g/L |

A.50℃ B.5l-52℃ C.45 - 55℃ D.60℃
| 共价键 | C=O | C-H | H-H | H-O |
| 键能 | 799 | 413 | 436 | 463 |

 CH3OH( g) +H2O(g)
CH3OH( g) +H2O(g) CO(g) +H2O(g)
CO(g) +H2O(g) 100%] 随温度的变化如图所示:
100%] 随温度的变化如图所示:

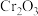 ,含有少量的
,含有少量的 )为原料制备铬酸铅,实现资源的回收再利用,其流程如下:
)为原料制备铬酸铅,实现资源的回收再利用,其流程如下:
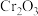 被氧化的反应的化学方程式为
被氧化的反应的化学方程式为 的溶液”分离提纯,依据如图所示的溶解度信息,“含
的溶液”分离提纯,依据如图所示的溶解度信息,“含 的溶液”分离提纯的操作是
的溶液”分离提纯的操作是
 ,同时放出二氧化碳,该转化过程的化学方程式为
,同时放出二氧化碳,该转化过程的化学方程式为