
 的反应条件与试剂是
的反应条件与试剂是 属于
属于 的化学方程式为
的化学方程式为 且能发生银镜反应的芳香族同分异构体有
且能发生银镜反应的芳香族同分异构体有 的结构简式为
的结构简式为 为原料合成具有止痛、退热药物
为原料合成具有止痛、退热药物 的路线
的路线
 可与
可与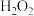 形成稳定的
形成稳定的 ,其原因是
,其原因是 转化为
转化为 ;将甲基橙、亚甲基蓝、HCHO转化为
;将甲基橙、亚甲基蓝、HCHO转化为 等。
等。

 在其中传导,已知La为+3价,则+3价钴与+4价钴的原子个数比为
在其中传导,已知La为+3价,则+3价钴与+4价钴的原子个数比为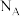 ,则该晶体的密度为
,则该晶体的密度为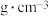 (列出计算式即可)。
(列出计算式即可)。  与
与 重整可以同时利用两种温室气体,其工艺过程涉及如下反应:
重整可以同时利用两种温室气体,其工艺过程涉及如下反应: ;
;
 ;
;
 ;
;
 、
、 各1.0mol及少量
各1.0mol及少量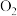 ,测得不同温度下反应平衡时各产物产量如图所示。
,测得不同温度下反应平衡时各产物产量如图所示。
 的产量随温度升高而下降的主要原因是
的产量随温度升高而下降的主要原因是 电催化转化合成气:
电催化转化合成气: 电还原反应机理如图所示,由图可知,催化剂选择纳米
电还原反应机理如图所示,由图可知,催化剂选择纳米 (纳米
(纳米 指的是含55个原子的
指的是含55个原子的 纳米颗粒),理由是
纳米颗粒),理由是
 电池能将二氧化碳(CO2)高效转化,研究表明,该电池反应产物为碳酸锂和单质碳,且
电池能将二氧化碳(CO2)高效转化,研究表明,该电池反应产物为碳酸锂和单质碳,且 电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤III的离子方程式。
电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤III的离子方程式。 II.
II.


 )的工艺流程如图1所示。草酸钕晶体的热重曲线如图2所示。
)的工艺流程如图1所示。草酸钕晶体的热重曲线如图2所示。 

 ,
, ,回答下列问题:
,回答下列问题: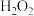 的目的是将
的目的是将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 时,该离子已被除尽。常温下,加入氢氧化钠溶液使溶液pH=4,此时
时,该离子已被除尽。常温下,加入氢氧化钠溶液使溶液pH=4,此时 是否已沉淀完全
是否已沉淀完全
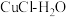 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
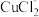 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中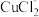 转化为
转化为 。电解时阳极发生的主要电极反应为
。电解时阳极发生的主要电极反应为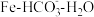 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收
热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收 制得的
制得的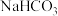 溶液反应,生成
溶液反应,生成 、
、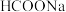 和
和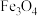 ;
;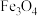 再经生物柴油副产品转化为Fe。
再经生物柴油副产品转化为Fe。 时,密闭容器中
时,密闭容器中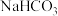 溶液与铁粉反应,反应初期有
溶液与铁粉反应,反应初期有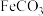 生成并放出
生成并放出 ,该反应的离子方程式为
,该反应的离子方程式为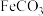 迅速转化为活性
迅速转化为活性 ,活性
,活性 是
是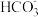 转化为
转化为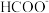 的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为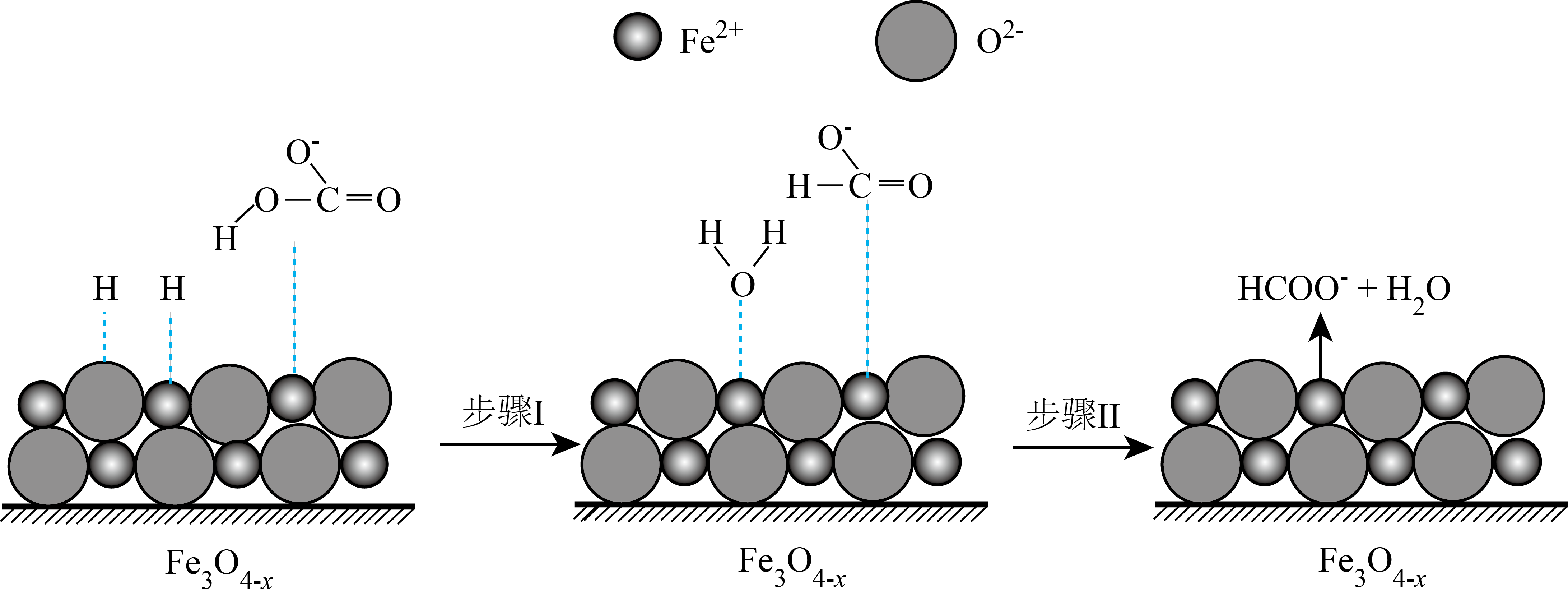
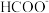 的产率随
的产率随 变化如题图所示。
变化如题图所示。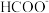 的产率随
的产率随 增加而增大的可能原因是
增加而增大的可能原因是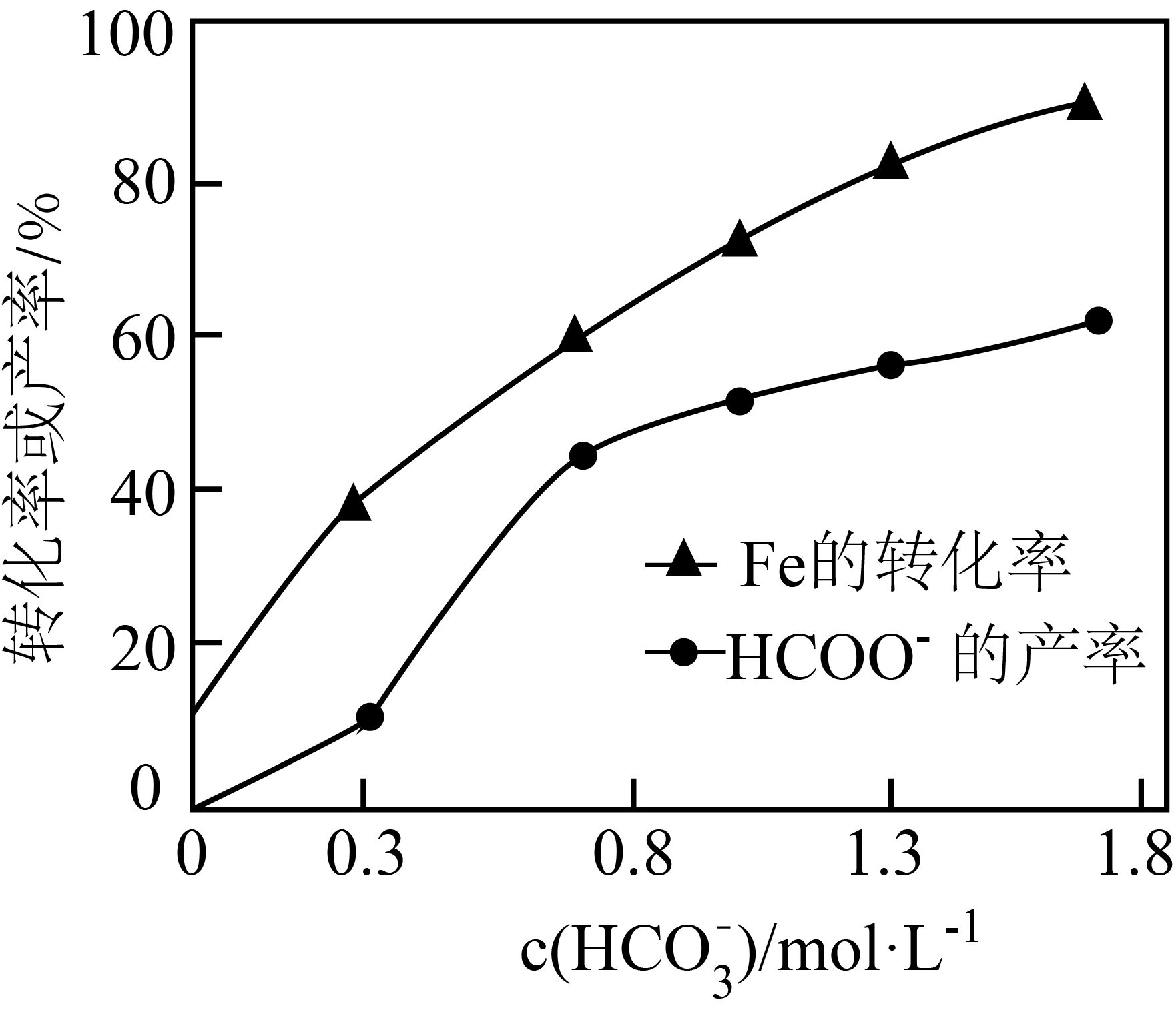
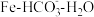 热循环制氢和甲酸”的优点是
热循环制氢和甲酸”的优点是 和乙烷反应制备乙烯。
和乙烷反应制备乙烯。
 与乙烷反应生成乙烯、CO和气态水的热化学方程式为
与乙烷反应生成乙烯、CO和气态水的热化学方程式为 制甲醇。以
制甲醇。以 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程: (无活性)
(无活性) (有活性)
(有活性) 与在活化后的催化剂表面可逆的发生反应①:
与在活化后的催化剂表面可逆的发生反应①:
 ,其反应历程如图1。
,其反应历程如图1。
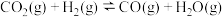

 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。
选择性的关系如图2。
 选择性
选择性 (生成
(生成 所消耗的
所消耗的 的量)
的量) (发生转化的
(发生转化的 的量)。
的量)。 选择性随流速增大而升高的原因是
选择性随流速增大而升高的原因是 的积累,减少反应
的积累,减少反应 制甲醇的过程,以下描述正确的是_______。
制甲醇的过程,以下描述正确的是_______。| A.碳的杂化方式没有发生改变 |
B.反应中经历了 、 、 键的形成和断裂 键的形成和断裂 |
C.加压可以提高 的平衡转化率 的平衡转化率 |
| D.升高温度可以提高甲醇在平衡时的选择性 |





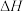 、
、 不随温度变化,平衡常数与温度间存在的关系为:
不随温度变化,平衡常数与温度间存在的关系为: ,R为正常数。则
,R为正常数。则

 (填“>”或“<”)。
(填“>”或“<”)。 的值。1000K,平衡时
的值。1000K,平衡时 ,则
,则

 、
、 为重要化工原料,常用于合成重要化合物。
为重要化工原料,常用于合成重要化合物。 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:




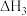
 为分压平衡常数,各反应的
为分压平衡常数,各反应的 随
随 的变化如图所示。
的变化如图所示。

 ,其对应的曲线为
,其对应的曲线为 投料,平衡时,CO和
投料,平衡时,CO和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图:
 的曲线为
的曲线为 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因 的平衡转化率始终低于
的平衡转化率始终低于 的
的
 的平衡转化率
的平衡转化率 的平衡产量先减小后增大
的平衡产量先减小后增大 超干重整
超干重整 得到的CO经偶联反应可制得
得到的CO经偶联反应可制得 (草酸)。
(草酸)。 、
、 和
和 物质的量分数与pH关系如图所示,则c点溶液
物质的量分数与pH关系如图所示,则c点溶液

 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝

 (草酸根)正极反应过程中,
(草酸根)正极反应过程中,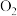 起催化作用,催化过程可表示为:①
起催化作用,催化过程可表示为:① ②……
②……
 RCH2OH+R1OH
RCH2OH+R1OH

A.化合物J具有碱性,与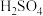 可反应生成 可反应生成 |
B.H在强碱溶液中水解产物之一为 |
| C.B→C的目的是保护酮羰基,防止其被氧化 |
D.左氧氟沙星的分子式是 |
 的化学方程式
的化学方程式 和
和 为原料合成
为原料合成 的路线
的路线 、
、 和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,
和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系, 时刻各改变一种条件,且改变的条件均不同。若
时刻各改变一种条件,且改变的条件均不同。若 时刻改变的条件是压强,则下列说法错误的是
时刻改变的条件是压强,则下列说法错误的是

A.若 ,则前 ,则前 的平均反应速率 的平均反应速率 |
B.该反应的化学方程式为 |
C. 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度 |
D.B的起始物质的量为 |
 )通常含有
)通常含有 ,某工业杂志报道,对
,某工业杂志报道,对 含量的测定可以先测量出样品中
含量的测定可以先测量出样品中 的含量,再计算出
的含量,再计算出 的纯度。实验步骤如下:
的纯度。实验步骤如下: 的HCl标准溶液滴定至红色刚好褪去且半分钟不变化,消耗HCl标准溶液的体积为VmL,重复滴定两次。
的HCl标准溶液滴定至红色刚好褪去且半分钟不变化,消耗HCl标准溶液的体积为VmL,重复滴定两次。A. | B. | C. | D. |
 ,滴定前后,HCl标准溶液的液面如图,则消耗HCl标准溶液的体积V=
,滴定前后,HCl标准溶液的液面如图,则消耗HCl标准溶液的体积V=
 的质量百分数为
的质量百分数为 。上述滴定过程中,
。上述滴定过程中, 的存在并不影响测量结果,可能的原因是
的存在并不影响测量结果,可能的原因是 与
与 的混合溶液,若测得混合液
的混合溶液,若测得混合液 ,则溶液中
,则溶液中
 的
的 与
与 氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示
氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示 的电离常数为
的电离常数为 含量的测定结果偏低的是_______(填字母)。
含量的测定结果偏低的是_______(填字母)。| A.锥形瓶用蒸馏水洗净后再用待测液润洗 |
| B.酸式滴定管用蒸馏水洗净后再用标准液润洗 |
| C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失 |
| D.滴定前读数正确,滴定后俯视滴定管读数 |