葡萄糖酸钙是一种有机钙盐,外观为白色结晶性或颗粒性粉末,无臭,无味,易溶于沸水,微溶于冷水,不溶于乙醇或乙醚等有机溶剂。葡萄糖酸钙临床上用于治疗骨质疏松症。实验室制备葡萄糖酸钙主要步骤如下:
I.葡萄糖酸溶液的制备
称取适量的葡萄糖[CH
2OH(CHOH)
4CHO],置于三颈烧瓶中,加入足量的溴水,在磁力搅拌器中沸水浴加热、搅拌得到无色透明的葡萄糖酸溶液。当氧化率达 80%以上时(60min),停止反应,把反应液冷却至 60-70℃待用。
Ⅱ.葡萄糖酸钙的制备
在搅拌下,分批加入足量的碳酸钙至葡萄糖酸溶液中。反应完全后,趁热用下图装置抽滤,得到澄清透明的葡萄糖酸钙溶液。将葡萄糖酸钙溶液转入 100ml 烧杯中冷却至室温,向烧杯中添加适量的无水乙醇,静置 10min 得到悬浊液,抽滤、洗涤、干燥得到白色的葡萄糖酸钙固体。

回答下列问题:
(1)步骤Ⅰ中,滴入溴水后,反应的化学方程式为
_______。
(2)步骤 Ⅱ 中,判断碳酸钙已经足量的实验现象是
_______。
(3)步骤Ⅱ抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是
_______;装置 B 的作用是
_______。
(4)洗涤操作洗涤剂最合适的是
________(填序号),理由是
_______。
A.冷水
B. 热水
C.乙醇
Ⅲ.葡萄糖酸钙中钙质量分数的测定
测定步骤:
(i)准确称取葡萄糖酸钙 m g,加入去离子水溶解,定容,配成 250mL 溶液。
(ii)用 c mol/L EDTA(H
2Y
2-)标准溶液润洗滴定管后,装入 EDTA 标准液,调至零刻度。
(iii)向 250mL 锥形瓶中加入 10mL 水、10mL NH
3-NH
4Cl 缓冲溶液和 5 mL 硫酸镁溶液。滴加 4 滴铬黑 T(HIn
2-)指示剂,摇匀。用 EDTA 标准液滴定至终点。记录消耗的 EDTA 标准液的体积。
滴定过程中发生的反应如下:
Mg
2+ + HIn
2-(蓝色)

MgIn
-(酒红色)+ H
+ Mg
2+ + H
2Y
2- 
MgY
2- + 2H
+ MgIn
-(酒红色)+ H
2Y
2- 
MgY
2- + H
+ + HIn
2-(蓝色)
(iv)向上述锥形瓶中加入 25.00 mL 葡萄糖酸钙溶液,摇匀,继续用 EDTA 标准液滴定至终点,记录消耗的 EDTA 标准液的总体积。平行滴定三次,测得步骤 iii 中消耗 EDTA 标准液的平均体积为 V
1 L,步骤 iv 中 EDTA 标准液的平均总体积为 V
2 L。
已知:配合物的稳定常数类似于化学平衡常数,如反应 Fe
3+ + 3SCN
-
Fe(SCN)
3 的平衡常数可以看做是 Fe(SCN)
3 的稳定常数 K
稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY
2- > MgY
2- > MgIn
- > CaIn
-,其中CaIn
-的稳定常数很小,CaIn
-不稳定,易导致滴定终点提前。
回答下列问题:
(5)步骤 iii 中加入硫酸镁的作用是
_______。
(6)滴定终点的颜色变化为
_______。
(7)步骤 iv 中,加入葡萄糖酸钙后发生反应的离子方程式为
_______,
_______。
(8)葡萄糖酸钙中钙的质量分数为
_______。(用 V
1、V
2、m、c 的代数式表示)

 CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:


 )共有
)共有
 MgIn-(酒红色)+ H+
MgIn-(酒红色)+ H+  MgY2- + 2H+
MgY2- + 2H+  MgY2- + H+ + HIn2-(蓝色)
MgY2- + H+ + HIn2-(蓝色)  Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
Fe(SCN)3 的平衡常数可以看做是 Fe(SCN)3 的稳定常数 K稳,一般情况下,配合物的稳定常数越大,配合物越稳定,两种离子更容易结合。已知下列化合物稳定常数的大小顺序为 CaY2- > MgY2- > MgIn- > CaIn-,其中CaIn-的稳定常数很小,CaIn-不稳定,易导致滴定终点提前。
 2NH3(g) ∆H=﹣92 kJ/mol
2NH3(g) ∆H=﹣92 kJ/mol
 Fe2(SO4)3+Na2SO4+14Na2O;
Fe2(SO4)3+Na2SO4+14Na2O;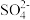 =PbSO4↓;
=PbSO4↓; Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
 可实现含苯酚废水的有效处理,工作原理如图所示,负极电极反应式为
可实现含苯酚废水的有效处理,工作原理如图所示,负极电极反应式为
 与
与 互为同系物
互为同系物 )的一氯代物有4种
)的一氯代物有4种 )的六氯代物有3种
)的六氯代物有3种 CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行:
CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行: FeO++N2;
FeO++N2; 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:

 + 6 e-=2 Cr(OH)3 + 8 OH-
+ 6 e-=2 Cr(OH)3 + 8 OH-