 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式: 难溶于水,常温时
难溶于水,常温时 ;
; 难溶于水,能溶于强酸、强碱。
难溶于水,能溶于强酸、强碱。 的
的 溶液中的
溶液中的 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),需加入等体积浓度至少为
),需加入等体积浓度至少为 的
的 溶液。
溶液。 在不同浓度的NaOH溶液中的最大溶解量(
在不同浓度的NaOH溶液中的最大溶解量( )如图1所示。下列叙述正确
)如图1所示。下列叙述正确
 越小
越小 不相等
不相等 时,随着NaOH浓度的增大,
时,随着NaOH浓度的增大, 溶解量减小是因为
溶解量减小是因为 浓度增大使
浓度增大使 溶解平衡逆向移动
溶解平衡逆向移动 时,溶液中
时,溶液中 一定最小
一定最小 ,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为
,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为 时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
 的关系如图。已知:
的关系如图。已知: 、
、
 。下列说法正确的
。下列说法正确的
A.上层清液中 |
B. 的溶液中 的溶液中 将逐渐减小 将逐渐减小 |
C. 时, 时, |
D.pH=7时, |
 ,可用于脱除煤气中的
,可用于脱除煤气中的 。脱硫剂的制备、硫化、再生过程可表示如图:
。脱硫剂的制备、硫化、再生过程可表示如图:
 催化下,CO将结核中的
催化下,CO将结核中的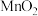 转化为
转化为 。发生反应的离子方程式为:
。发生反应的离子方程式为: ;
; 沉淀。现用5 L一定浓度的
沉淀。现用5 L一定浓度的 溶液将其全部转化为
溶液将其全部转化为 ,需
,需 溶液的浓度至少为
溶液的浓度至少为 (用含a的表达式表示)。已知:
(用含a的表达式表示)。已知: ,
, 。
。 在空气中煅烧可制得脱硫剂
在空气中煅烧可制得脱硫剂 。
。 )随温度变化的曲线如图1所示。975 K时,煅烧
)随温度变化的曲线如图1所示。975 K时,煅烧 后得到固体产物为
后得到固体产物为
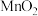 的晶胞结构如图2所示,图中已表示出晶胞边长及坐标轴,图3为沿y轴方向晶胞投影图。请在图4方框中画出沿z轴方向的晶胞投影图。
的晶胞结构如图2所示,图中已表示出晶胞边长及坐标轴,图3为沿y轴方向晶胞投影图。请在图4方框中画出沿z轴方向的晶胞投影图。
 催化重整
催化重整 技术可得到富含CO的化工原料。回答下列问题:
技术可得到富含CO的化工原料。回答下列问题: 催化重整
催化重整 的催化转化如图所示:
的催化转化如图所示:

 理论上生成2molCO
理论上生成2molCO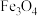 、CaO为中间产物
、CaO为中间产物 、CO,测得平衡时
、CO,测得平衡时 的体积分数与温度、压强的关系如图所示。温度为
的体积分数与温度、压强的关系如图所示。温度为 ℃、压强为
℃、压强为 时,N点表示的体系状态
时,N点表示的体系状态
 (填“>”、“=”或“<”);M点表示的体系状态
(填“>”、“=”或“<”);M点表示的体系状态 的平衡转化率为
的平衡转化率为
 和
和 的分压分别为20kPa、30kPa,加入
的分压分别为20kPa、30kPa,加入 催化剂并加热至1123K使其发生反应
催化剂并加热至1123K使其发生反应 。
。 ,某时刻测得
,某时刻测得 ,则
,则

 。
。
 (用各物质的分压代替物质的量浓度计算)。
(用各物质的分压代替物质的量浓度计算)。 催化剂可使
催化剂可使 “甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为
“甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为




| A.化合物A转化为B的反应类型为取代反应 |
| B.化合物C与E可用新制氢氧化铜悬浊液鉴别 |
| C.化合物F的含氧官能团中含有醛基 |
D.化合物L的分子式是 |
 反应的化学方程式
反应的化学方程式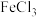 溶液显紫色
溶液显紫色
 和
和 为原料制备
为原料制备 的合成路线(用流程图表示,无机试剂任选):
的合成路线(用流程图表示,无机试剂任选):| A.若混合后溶液pH=7,则c(NH4+)=c(Cl-) |
| B.若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D.若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=1 |

| A.图中②点所示溶液的导电能力弱于①点 |
| B.③点处水电离出的c(H+)=1×10-8mol·L-1 |
| C.图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| D.25℃时氨水的Kb约为5×10-5.6mo1·L-1 |




| A.X可能为正盐,也可能为酸式盐 | B.将b通入a的水溶液中可能生成白色沉淀 |
| C.a、b、c、d、e、f可能都是极性分子 | D.反应①、②可能具有相同的实验现象 |

 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O