金属矿物的冶炼和用途
I.金属矿物的用途
(1)焦炭的生产方法是烟煤在隔绝空气的条件下,加热到950-1050℃,经过干燥、热解、熔融、粘结、固化、收缩等阶段最终制成焦炭,这一过程叫高温炼焦。请写出焦炭在高炉炼铁中的作用
____。
(2)画作的青色用到蓝铜矿,其主要成分为Cux(OH)
2(СО
З)
2,则x=
_____。
(3)画作中所用的红色矿物颜料赭石在中医领域也有应用,赭石具有促进血液新陈代谢的作用,原因是赭石中含有的元素名称是
_____(写名称)。赭石也可以作为冶炼金属的原料,写出其与CO反应的化学方程式
_____。
II.金属矿物的煅造
用磁铁矿烧渣(主要成分为Fe
3O
4、SiO
2等)为原料制备碳酸亚铁的生产流程示意图。


【资料】40℃以上时,(NH
4)
2CO
3易分解。
(4)操作Ⅰ、Ⅱ均为
______,该操作中需要将圆形滤纸折叠处理,图2中不该出现的情形是
_________(填字母序号)。
(5)向磁铁矿烧渣中通入CO发生反应的化学方程式为
______。
(6)操作Ⅰ中加入过量硫酸的目的是
_____,在加入适量氨水前,溶液B中除含有水以外,还含有
_________;操作Ⅱ的温度不能过高的目的是
_____。
III.实验室探究铜的冶炼
已知:H
2+CuO

Cu+H
2O。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu
2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。铜不与氨水发生发生反应。某兴趣小组对此开展如下探究。

III-I、设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。
(7)图1中制取氢气的化学反应方程式为
______。
(8)实验开始时,______(填序号)
| A.先向长颈漏斗中加稀硫酸后点酒精灯 |
| B.先点燃酒精灯加热后向长颈漏斗中加稀硫酸 |
(9)取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到
_____,证明固体产物有Cu
2O。
III-II、探究反应生成Cu
2O的变化情况。
称取若干份质量均为0.8000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu
2O的质量(m),结果如图2。
(10)由图2可知,在氢气还原氧化铜反应过程中,Cu
2O质量的变化趋势是
______。
(11)为确保氢气还原氧化铜所得固体产物不含Cu
2O,应采取的措施是
______。
III、探究反应生成Cu
2O的原因。
为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1:经历2CuO+H
2
Cu
2O+H
2O,H
2+Cu
2O

2Cu+H
2O两个反应,且在同一条件下两个反应同时进行。
假设2:依次经历CuO+H
2
Cu+H
2O、Cu+CuO

Cu
2O、H
2+Cu
2O

2Cu+H
2O三个反应。
(12)结合探究Ⅱ的结果,通过计算分析,如果0.8000g的CuO全部转化Cu
2O,则得到Cu
2O的质量为
______,所以假设
______合理(1或2)。
 所示的实验流程。
所示的实验流程。


 -1)m0
-1)m0
 MgO+H2O;碳酸钙高温下才分解。某兴趣小组为测定其中各成分的质量分数,取12.9g水垢样品加热,加热过程中剩余固体的质量随加热时间的变化如图所示。关于加热一段时间后剩余固体的判断,下列说法不正确的是
MgO+H2O;碳酸钙高温下才分解。某兴趣小组为测定其中各成分的质量分数,取12.9g水垢样品加热,加热过程中剩余固体的质量随加热时间的变化如图所示。关于加热一段时间后剩余固体的判断,下列说法不正确的是
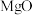 和
和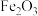 的固体混合物,向其中加入100g溶质质量分数为9.8%的稀硫酸,恰好完全反应后,得到该温度下的不饱和溶液104.8g。下列说法中,正确的是
的固体混合物,向其中加入100g溶质质量分数为9.8%的稀硫酸,恰好完全反应后,得到该温度下的不饱和溶液104.8g。下列说法中,正确的是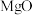 和
和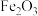 固体混合物的质量为4.8g
固体混合物的质量为4.8g ”、“
”、“ ”、“
”、“ ”分别表示氧元素和另外两种元素的原子,则下列表示的物质中,属于氧化物的是( )
”分别表示氧元素和另外两种元素的原子,则下列表示的物质中,属于氧化物的是( )





 Cu+H2O。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。铜不与氨水发生发生反应。某兴趣小组对此开展如下探究。
Cu+H2O。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。铜不与氨水发生发生反应。某兴趣小组对此开展如下探究。
 Cu2O+H2O,H2+Cu2O
Cu2O+H2O,H2+Cu2O 2Cu+H2O两个反应,且在同一条件下两个反应同时进行。
2Cu+H2O两个反应,且在同一条件下两个反应同时进行。 Cu+H2O、Cu+CuO
Cu+H2O、Cu+CuO Cu2O、H2+Cu2O
Cu2O、H2+Cu2O 2Cu+H2O三个反应。
2Cu+H2O三个反应。





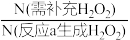 ≥
≥ 和HCl的混合溶液中逐滴加入Ba(OH)2溶液至过量,生成沉淀的质量与所加Ba(OH)2溶液的质量之间的关系如图所示。下列相关说法正确的是
和HCl的混合溶液中逐滴加入Ba(OH)2溶液至过量,生成沉淀的质量与所加Ba(OH)2溶液的质量之间的关系如图所示。下列相关说法正确的是




 ,然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
,然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
 Co+2CO2↑
Co+2CO2↑