 )在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用。某化学研究性学习小组设计并完成了如下实验。
)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用。某化学研究性学习小组设计并完成了如下实验。
(实验目的)测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
[实验原理]

[交流与讨论]
I、甲同学认为测定产物中
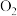 的体积即可测定样品的纯度。
的体积即可测定样品的纯度。(1)写出装置②内发生的一个化学反应的方程式
(2)实验结束后,装置中会残留部分的氧气,这会使计算结果
(3)若室温下氧气的密度为1.28g/L,甲同学通过简单计算后,认为所取用过碳酸钠样品的质量最好不超过4.88g,甲同学的理由是
II、乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定过碳酸钠样品的纯度。但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是
A 浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B 滴加浓盐酸的速度过快,产生的二氧化碳不能被装置②完全吸收
C 装置①、②内空气中的二氧化碳被装置②吸收
D 二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
III、丙同学提出了一种新方案,得到大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将锥形瓶内所有的液体蒸发、结晶,称得氯化钠固体11.7g,则该样品的质量分数为

同类型试题

y = sin x, x∈R, y∈[–1,1],周期为2π,函数图像以 x = (π/2) + kπ 为对称轴
y = arcsin x, x∈[–1,1], y∈[–π/2,π/2]
sin x = 0 ←→ arcsin x = 0
sin x = 1/2 ←→ arcsin x = π/6
sin x = √2/2 ←→ arcsin x = π/4
sin x = 1 ←→ arcsin x = π/2
y = sin x, x∈R, y∈[–1,1],周期为2π,函数图像以 x = (π/2) + kπ 为对称轴
y = arcsin x, x∈[–1,1], y∈[–π/2,π/2]
sin x = 0 ←→ arcsin x = 0
sin x = 1/2 ←→ arcsin x = π/6
sin x = √2/2 ←→ arcsin x = π/4
sin x = 1 ←→ arcsin x = π/2
 搜索
搜索

