全一卷
1.某试剂瓶标签上安全标志如图,该试剂是




| A.氨水 | B.乙酸 | C.氢氧化钠 | D.硝酸 |
2.我国古代典籍中有“石胆……浅碧色,烧之变白色者真”的记载,其中石胆是指
A. | B. |
C. | D. |
3.反应C2H6(g) C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是
 C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是| A.增大容器容积 | B.升高反应温度 |
| C.分离出部分氢气 | D.等容下通入惰性气体 |
4.下列各组化合物中不互为同分异构体的是
A. | B. |
C. | D. |
5.根据图中的能量关系,可求得 的键能为
的键能为

 的键能为
的键能为
A. | B. | C. | D. |
6.实验室通过称量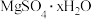 样品受热脱水前后的质量来测定x值,下列情况会导致测定值偏低的是
样品受热脱水前后的质量来测定x值,下列情况会导致测定值偏低的是
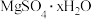 样品受热脱水前后的质量来测定x值,下列情况会导致测定值偏低的是
样品受热脱水前后的质量来测定x值,下列情况会导致测定值偏低的是| A.实验前试样未经干燥 | B.试样中含有少量碳酸氢铵 |
| C.试样中含有少量氯化钠 | D.加热过程中有试样迸溅出来 |
7.下列说法正确的是
A.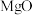 和 和 都属于两性氧化物 都属于两性氧化物 | B.悬浊液和乳浊液的分散质均为液态 |
C.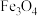 和 和 中的金属都呈现两种价态 中的金属都呈现两种价态 | D.葡萄糖溶液和淀粉溶液都具有丁达尔效应 |
8.今年是门捷列夫发现元素周期律150周年,联合国将2019年定为“国际化学元素周期表年”。下列有关化学元素周期表的说法正确的是
| A.元素周期表共有18列 |
| B.VIIA族元素的非金属性自上而下依次减弱 |
| C.主族元素均呈现与其族数相同的最高化合价 |
| D.第二周期主族元素的原子半径自左向右依次增大 |
9.微型银-锌电池可用作电子仪器的电源,其电极分别是 和
和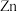 ,电解质为
,电解质为 溶液,电池总反应为
溶液,电池总反应为 ,下列说法正确的是
,下列说法正确的是
 和
和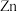 ,电解质为
,电解质为 溶液,电池总反应为
溶液,电池总反应为 ,下列说法正确的是
,下列说法正确的是A.电池工作过程中, 溶液浓度降低 溶液浓度降低 |
B.电池工作过程中,电解液中 向负极迁移 向负极迁移 |
C.负极发生反应 |
D.正极发生反应 |
10.一定温度下,AgCl(s) Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是
Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是
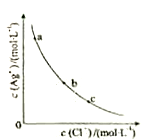
 Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是
Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是
| A.a、b、c三点对应的Ksp相等 |
| B.AgCl在c点的溶解度比b点的大 |
| C.AgCl溶于水形成的饱和溶液中,c(Ag+)=c(Cl-) |
| D.b点的溶液中加入AgNO3固体,c(Ag+)沿曲线向c点方向变化 |
11.能正确表示下列反应的离子方程式为( )
| A.向FeBr2溶液中通入过量Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| B.向碳酸钠溶液中通入少量CO2:CO32-+CO2+H2O=2HCO3- |
| C.向碘化钾溶液中加入少量双氧水:3H2O2+I-=IO3-+3H2O |
| D.向硫化钠溶液中通入过量SO2:2S2-+5SO2+2H2O=3S↓+4HSO3- |
12.下列化合物中,既能发生取代反应又能发生加成反应的有
| A.CH3-CH=CH2 | B.CH3CH2CH2OH |
C. | D. |
13.自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。回答下列问题:
(1)2016年 确认了四种新元素,其中一种为
确认了四种新元素,其中一种为 ,中文名为“
,中文名为“ ”。元素
”。元素 可由反应:
可由反应: +
+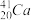 =
=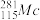 +3
+3 得到。该元素的质子数为
得到。该元素的质子数为______ ,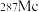 与
与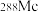 互为
互为_________ 。
(2) 位于元素周期表中第
位于元素周期表中第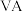 族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式
族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式________________ .该分子内存在的共价键类型有_______ 。
(3)该族中的另一元素P能呈现多种化合价,其中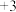 价氧化物的分子式为
价氧化物的分子式为______ , 价简单含氧酸的分子式为
价简单含氧酸的分子式为______ 。
(1)2016年
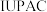 确认了四种新元素,其中一种为
确认了四种新元素,其中一种为 ,中文名为“
,中文名为“ ”。元素
”。元素 可由反应:
可由反应: +
+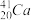 =
=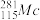 +3
+3 得到。该元素的质子数为
得到。该元素的质子数为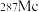 与
与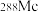 互为
互为(2)
 位于元素周期表中第
位于元素周期表中第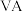 族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式
族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式(3)该族中的另一元素P能呈现多种化合价,其中
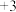 价氧化物的分子式为
价氧化物的分子式为 价简单含氧酸的分子式为
价简单含氧酸的分子式为14.无机酸有机酯在生产中具有广泛的应用,回答下列问题:
(1)硫酸氢乙酯(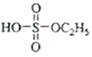 )可看作是硫酸与乙醇形成的单酯,工业上常通乙烯与浓硫酸反应制得,该反应的化学方程式为_________,反应类型为__________,写出硫酸与乙醇形成的双酯—硫酸二乙酯(
)可看作是硫酸与乙醇形成的单酯,工业上常通乙烯与浓硫酸反应制得,该反应的化学方程式为_________,反应类型为__________,写出硫酸与乙醇形成的双酯—硫酸二乙酯(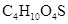 )的结构简式_____。
)的结构简式_____。
(2)磷酸三丁酯常作为稀土元素富集时的萃取剂,工业上常用正丁醇与三氯氧磷(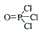 )反应来制备,该反应的化学方程式为__________,反应类型为________。写出正丁醇的任意一个醇类同分异构体的结构简式___________。
)反应来制备,该反应的化学方程式为__________,反应类型为________。写出正丁醇的任意一个醇类同分异构体的结构简式___________。
(1)硫酸氢乙酯(
 )可看作是硫酸与乙醇形成的单酯,工业上常通乙烯与浓硫酸反应制得,该反应的化学方程式为_________,反应类型为__________,写出硫酸与乙醇形成的双酯—硫酸二乙酯(
)可看作是硫酸与乙醇形成的单酯,工业上常通乙烯与浓硫酸反应制得,该反应的化学方程式为_________,反应类型为__________,写出硫酸与乙醇形成的双酯—硫酸二乙酯(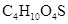 )的结构简式_____。
)的结构简式_____。(2)磷酸三丁酯常作为稀土元素富集时的萃取剂,工业上常用正丁醇与三氯氧磷(
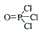 )反应来制备,该反应的化学方程式为__________,反应类型为________。写出正丁醇的任意一个醇类同分异构体的结构简式___________。
)反应来制备,该反应的化学方程式为__________,反应类型为________。写出正丁醇的任意一个醇类同分异构体的结构简式___________。15.连二亚硫酸钠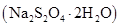 ,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
(1)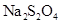 中S的化合价为______。
中S的化合价为______。
(2)向锌粉的悬浮液中通入 ,制备
,制备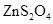 ,生成
,生成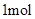
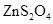 ,反应中转移的电子数为____mol;向
,反应中转移的电子数为____mol;向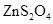 溶液中加入适量
溶液中加入适量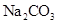 ,生成
,生成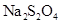 并有沉淀产生,该反应的化学方程式为_________
并有沉淀产生,该反应的化学方程式为_________
(3)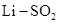 电池具有高输出功率的优点。其正极为可吸附
电池具有高输出功率的优点。其正极为可吸附 的多孔碳电极,负极为金属锂,电解液为溶解有
的多孔碳电极,负极为金属锂,电解液为溶解有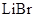 的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为
的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为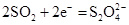 ,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
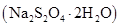 ,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:(1)
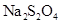 中S的化合价为______。
中S的化合价为______。(2)向锌粉的悬浮液中通入
 ,制备
,制备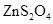 ,生成
,生成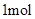
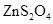 ,反应中转移的电子数为____mol;向
,反应中转移的电子数为____mol;向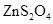 溶液中加入适量
溶液中加入适量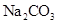 ,生成
,生成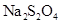 并有沉淀产生,该反应的化学方程式为_________
并有沉淀产生,该反应的化学方程式为_________(3)
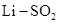 电池具有高输出功率的优点。其正极为可吸附
电池具有高输出功率的优点。其正极为可吸附 的多孔碳电极,负极为金属锂,电解液为溶解有
的多孔碳电极,负极为金属锂,电解液为溶解有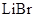 的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为
的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为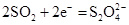 ,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。16.由 羟基丁酸生成
羟基丁酸生成 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH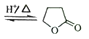 +H2O
+H2O
在298K下, 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为 ,测得
,测得 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
(1)该反应在50~80min内的平均反应速率为_____ 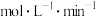 。
。
(2)120min时 羟基丁酸的转化率为
羟基丁酸的转化率为______ 。
(3)298K时该反应的平衡常数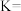
_____ 。
(4)为提高 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______ 。
 羟基丁酸生成
羟基丁酸生成 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH +H2O
+H2O 在298K下,
 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为 ,测得
,测得 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题: | 21 | 50 | 80 | 100 | 120 | 160 | 220 |  |
 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)该反应在50~80min内的平均反应速率为
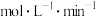 。
。(2)120min时
 羟基丁酸的转化率为
羟基丁酸的转化率为(3)298K时该反应的平衡常数
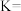
(4)为提高
 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是17.干燥的二氧化碳和氨气反应可生成氨基甲酸铵固体,化学方程式为: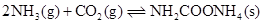
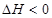 ,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
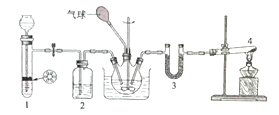
(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为____ ;装置2中所加试剂为____ ;
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为________ ;试管口不能向上倾斜的原因是__________ 。装置3中试剂为KOH,其作用为______________ 。
(3)反应时三颈瓶需用冷水浴冷却,其目的是_______________________ 。
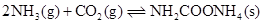
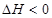 ,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为
(3)反应时三颈瓶需用冷水浴冷却,其目的是
18.18-Ⅰ分子中只有两种不同化学环境的氢,且数目比为3:2的化合物(________ )
A.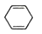 B.
B. 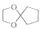 C.
C.  D.
D. 
Ⅱ奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
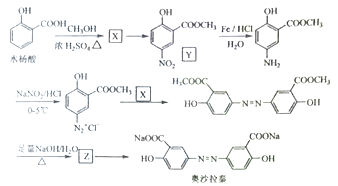
回答下列问题:
(1)X的结构简式为____ ;由水杨酸制备X的反应类型为_____ 。
(2)由X制备Y的反应试剂为_________ 。
(3)工业上常采用廉价的 ,与Z反应制备奥沙拉秦,通入的
,与Z反应制备奥沙拉秦,通入的 与Z的物质的量之比至少应为
与Z的物质的量之比至少应为____ 。
(4)奥沙拉秦的分子式为______ ,其核磁共振氢谱为______ 组峰,峰面积比为______ 。
(5)若将奥沙拉秦用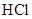 酸化后,分子中含氧官能团的名称为
酸化后,分子中含氧官能团的名称为____ 。
(6)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为_______ 。
A.
 B.
B.  C.
C.  D.
D. 
Ⅱ奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:

回答下列问题:
(1)X的结构简式为
(2)由X制备Y的反应试剂为
(3)工业上常采用廉价的
 ,与Z反应制备奥沙拉秦,通入的
,与Z反应制备奥沙拉秦,通入的 与Z的物质的量之比至少应为
与Z的物质的量之比至少应为(4)奥沙拉秦的分子式为
(5)若将奥沙拉秦用
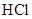 酸化后,分子中含氧官能团的名称为
酸化后,分子中含氧官能团的名称为(6)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为
19.Ⅰ.下列各组物质性质的比较,结论正确的是(____________ )
A. 分子的极性: B. 物质的硬度:
B. 物质的硬度: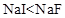
C. 物质的沸点: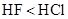 D.在
D.在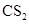 中的溶解度:
中的溶解度: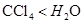
Ⅱ.锰单质及其化合物应用十分广泛。回答下列问题:

(1)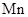 位于元素周期表中第四周期
位于元素周期表中第四周期____ 族,基态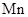 原子核外未成对电子有
原子核外未成对电子有_____ 个。
(2)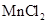 可与
可与 反应生成
反应生成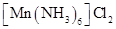 ,新生成的化学键为
,新生成的化学键为_____ 键。 分子的空间构型为
分子的空间构型为______ ,其中N原子的杂化轨道类型为_______ 。
(3)金属锰有多种晶型,其中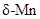 的结构为体心立方堆积,晶胞参数为apm,
的结构为体心立方堆积,晶胞参数为apm,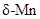 中锰的原子半径为
中锰的原子半径为_____ pm。已知阿伏加德罗常数的值为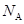 ,
,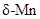 的理论密度
的理论密度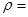
____ 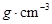 。(列出计算式)
。(列出计算式)
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为____ ,其配位数为____ 。
A. 分子的极性:
 B. 物质的硬度:
B. 物质的硬度: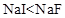
C. 物质的沸点:
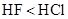 D.在
D.在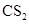 中的溶解度:
中的溶解度: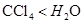
Ⅱ.锰单质及其化合物应用十分广泛。回答下列问题:

(1)
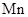 位于元素周期表中第四周期
位于元素周期表中第四周期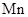 原子核外未成对电子有
原子核外未成对电子有(2)
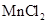 可与
可与 反应生成
反应生成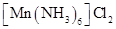 ,新生成的化学键为
,新生成的化学键为 分子的空间构型为
分子的空间构型为(3)金属锰有多种晶型,其中
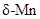 的结构为体心立方堆积,晶胞参数为apm,
的结构为体心立方堆积,晶胞参数为apm,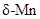 中锰的原子半径为
中锰的原子半径为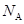 ,
,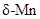 的理论密度
的理论密度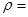
 。(列出计算式)
。(列出计算式)(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为
 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错
