全一卷
1.远古时期,半坡人从事的下列生活、生产活动中,一定有化学变化的是
| A.夯筑土屋 | B.结绳记事 |
| C.磨制石器 | D.烧制彩陶 |
2.下列物质均可用于配制灭活新型冠状病毒的消毒剂,其中属于无机化合物的是
| A.过氧化氢(H2O2) | B.乙醇(C2H6O) |
| C.三氯甲烷(CHCl3) | D.过氧乙酸(C2H4O3) |
3.在制取氢气( )的实验中,下列操作正确的是
)的实验中,下列操作正确的是
 )的实验中,下列操作正确的是
)的实验中,下列操作正确的是A.检查气密性 | B.加入锌粒 |
C.加入稀硫酸 | D.收集氢气 |
4.下列食物中,蛋白质含量最高的是
| A.米饭 | B.瘦肉 | C.青菜 | D.玉米油 |
5.“加铁酱油”“高锌奶粉”“富硒茶叶”中,“铁、锌、硒”指的是
| A.单质 | B.元素 | C.金属 | D.维生素 |
6.下列物质的性质与其用途不匹配的是
| A.石墨质软——用作电池的电极材料 |
| B.不锈钢耐腐蚀——制造医疗器械 |
| C.熟石灰显碱性——用来改良酸性土壤 |
| D.干冰易升华——用于人工降雨 |
7.2020年6月23日,我国“长三乙”火箭将第55颗北斗卫星送入预定轨道,完成北斗卫星导航系统的组网。该火箭第三级的推进剂为液氢和液氧组合,下列说法正确的是
| A.氢气液化过程中,氢分子之间的间隔保持不变 |
| B.分离液态空气得到液氧的过程中,氧分子静止不动 |
| C.液氧变成气态氧时,放出热量 |
| D.氢气与氧气反应的本质是氢、氧原子的重新组合 |
8.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
| 温度/℃ | 0 | 20 | 40 | 60 |
| NaCl的溶解度/g | 35.7 | 36.0 | 36.6 | 37.3 |
| KNO3的溶解度/g | 13.3 | 31.6 | 63.9 | 110 |
| A.20℃时,100gH2O最多能溶解36.0gNaCl |
| B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9% |
| C.可用冷却海水的方法获取大量食盐 |
| D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液 |
9.下列实验操作能达到实验目的的是
| 实验目的 | 实验操作 | |
| A | 测定某废水的酸碱度 | 取样,将湿润的pH试纸浸入样品中 |
| B | 除去水中的色素 | 将水通过装有活性炭的净化装置 |
| C | 除去粗盐中的难溶性杂质 | 溶解、蒸发、结晶 |
| D | 检验某固体是否为铵态氮肥 | 取样,加稀盐酸,闻气味 |
| A.A | B.B | C.C | D.D |
10.将一定浓度的稀盐酸、稀硫酸分别加入装有等质量CaCO3粉末的容器中,相同条件下测得两者产生的CO2体积(V)与反应时间(t)的关系如下图所示。下列判断错误的是
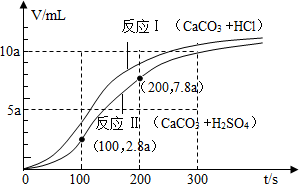

| A.0~300s内,两个容器内溶液的pH均逐渐增大 |
| B.0-100s内,反应Ⅰ、Ⅱ生成CO2的速率均先慢后快 |
| C.反应Ⅱ中,0~100s内产生的CO2体积比100-200s内的少5amL |
| D.实验室可以用一定浓度的稀硫酸与CaCO3粉末反应制备CO2 |
11.模型认知是建立宏观与微观联系的思维方法。
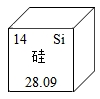
(1)①如图为硅在元素周期表中的部分信息,硅的相对原子质量为_____ 。
②如图为氧原子结构示意图,x的数值为____________ 。在化学变化中,氧原子容易 ___________ (填“得到”或“失去”)电子。

(2)某化学反应的微观示意图如下:
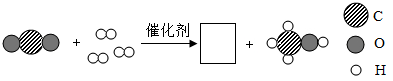
①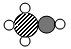 所表示的微粒中,碳、氢、氧原子的个数比为
所表示的微粒中,碳、氢、氧原子的个数比为 _____
② 处的微粒是
处的微粒是 _____
(3)道尔顿原子学说的部分观点如下:
①原子是不可分割的实心球体;
②物质都是由原子构成的;
③同种元素的所有原子的质量完全相同。
现代科学证实以上观点均不确切,请选择其中一个观点简要说明:___
(1)①如图为硅在元素周期表中的部分信息,硅的相对原子质量为

②如图为氧原子结构示意图,x的数值为

(2)某化学反应的微观示意图如下:

①
 所表示的微粒中,碳、氢、氧原子的个数比为
所表示的微粒中,碳、氢、氧原子的个数比为 ②
 处的微粒是
处的微粒是 (3)道尔顿原子学说的部分观点如下:
①原子是不可分割的实心球体;
②物质都是由原子构成的;
③同种元素的所有原子的质量完全相同。
现代科学证实以上观点均不确切,请选择其中一个观点简要说明:
12.燃烧与人类生产、生活有着密切的关系。
(1)下列成语的原意与燃烧不相关的是____ (填标号)。
A 卧薪尝胆 B釜底抽薪
C 火上浇油 D 煽风点火
(2)古籍《天工开物》就有“煤饼烧石成灰”的记载。“烧石成灰”指高温条件下碳酸钙转化为生石灰。
①“煤饼烧石成灰”的过程中,能量转化的主要方式是_______ 。
②“石”转化为“灰”的反应属于___ (填基本反应类型)。
③“灰”遇水成浆,该反应的化学方程式为_____ 。
(3)室内起火时,如果急于打开门窗,火反而会烧得更旺。原因是_____ 。
(1)下列成语的原意与燃烧不相关的是
A 卧薪尝胆 B釜底抽薪
C 火上浇油 D 煽风点火
(2)古籍《天工开物》就有“煤饼烧石成灰”的记载。“烧石成灰”指高温条件下碳酸钙转化为生石灰。
①“煤饼烧石成灰”的过程中,能量转化的主要方式是
②“石”转化为“灰”的反应属于
③“灰”遇水成浆,该反应的化学方程式为
(3)室内起火时,如果急于打开门窗,火反而会烧得更旺。原因是
13.科学使用化学物质,可以保障人体健康。
(1)某同学的部分体液的pH如图所示。

①图中碱性最强的体液是____ 。
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平【主要成分为Al(OH)3】治疗,其原理是__ (用化学方程式表示)。
(2)某84消毒液产品的部分说明如下表。
依据表中信息,将有效氯的质量分数为6.0%的84消毒液与水按质量比为1:___ 进行稀释,即可用于餐具消毒。洁厕灵(主要成分为盐酸)与84消毒液混合会产生有毒的氯气(Cl2)。请将该反应的化学方程式补充完整: 2HCl+NaClO=______ +Cl2↑+H2O。
(1)某同学的部分体液的pH如图所示。

①图中碱性最强的体液是
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平【主要成分为Al(OH)3】治疗,其原理是
(2)某84消毒液产品的部分说明如下表。
| 84消毒液 【产品特点】主要成分为次氯酸钠(NaClO),有效氯的质量分数为5.1%~6.9%。 【餐具消毒】用有效氯的质量分数为0.04%的消毒液浸泡,20min后用生活饮用水冲净。 【注意事项】①外用消毒剂,须稀释后使用。 ②不得将本产品与酸性产品(如洁厕类清洁产品)同时使用。 |
依据表中信息,将有效氯的质量分数为6.0%的84消毒液与水按质量比为1:
14.合理利用化石燃料资源,是人类不断探索的课题。某城市家用燃料的使用经历了下图所示的过程,并将逐步向理想燃料发展。

(注:括号中的物质是对应燃料的主要成分)
(1)CH4、C3H8两种物质中,氢元素的质量分数较大的是___ (填化学式)。
(2)倡导“家用燃料低碳化”的意义是______ 。
(3)一定条件下,仅用一个置换反应即可制得CO和H2,反应的化学方程式为___ 。
(4)随着全球能源使用量的增长,化石燃料等不可再生能源将日趋枯竭。请提出一个缓解能源危机的设想:______ 。

(注:括号中的物质是对应燃料的主要成分)
(1)CH4、C3H8两种物质中,氢元素的质量分数较大的是
(2)倡导“家用燃料低碳化”的意义是
(3)一定条件下,仅用一个置换反应即可制得CO和H2,反应的化学方程式为
(4)随着全球能源使用量的增长,化石燃料等不可再生能源将日趋枯竭。请提出一个缓解能源危机的设想:
15.“铜的循环”如下图所示。其中,箭号表示能一步实现的物质转化方向,X、Y、Z是初中化学常见的物质。
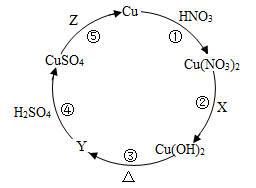
(1)若反应①为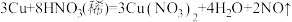 ,预测该反应可能观察到的实验现象:
,预测该反应可能观察到的实验现象:______ (写一个)。
(2)反应②中,X的化学式是_____ (写一个)。
(3)Y是黑色固体,反应④的化学方程式为_________ 。
(4)利用反应⑤的转化原理,除去FeSO4溶液中的少量CuSO4。需要的药品和分离方法分别是____ 、______ 。
(5)已知:同一化学反应中,若有元素的化合价升高,则必有元素的化合价降低。铜曝露在空气中生成铜锈【主要成分为Cu2(OH)2CO3】的过程中,空气中参与反应的物质是_______ 。

(1)若反应①为
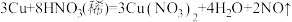 ,预测该反应可能观察到的实验现象:
,预测该反应可能观察到的实验现象:(2)反应②中,X的化学式是
(3)Y是黑色固体,反应④的化学方程式为
(4)利用反应⑤的转化原理,除去FeSO4溶液中的少量CuSO4。需要的药品和分离方法分别是
(5)已知:同一化学反应中,若有元素的化合价升高,则必有元素的化合价降低。铜曝露在空气中生成铜锈【主要成分为Cu2(OH)2CO3】的过程中,空气中参与反应的物质是
16.请将下列实验报告补充完整。
| 实验内容 | 现象 | 说明、解释或结论 |
| (1)用高锰酸钾制取氧气。 连接仪器,检查装置气密性。用 | 当观察到 | 收集O2之前,将集气瓶内空气完全排净的方法是 |
| (2)酸与碱发生中和反应。 i.取少量稀NaOH溶液于试管中,滴入2滴酚酞溶液,再逐滴加入稀盐酸,边滴边振荡,至溶液的颜色恰好变为无色。 ii.往上述无色溶液中再滴入1滴稀NaOH溶液,观察现象。 | 步骤ⅱ中观察到 | 步骤i中“边滴边振荡”的目的是 |
17.欲证明“CO2与NaOH发生了化学反应”,某化学兴趣小组进行以下探究实验(实验装置中夹持仪器已略去)。
【实验1】配制溶液
(1)用NaOH固体配制20g20%NaOH溶液,无需用到的玻璃仪器有___ (填标号)。
A 胶头滴管 B 酒精灯 C 量筒 D 烧杯 E 玻璃棒
【实验2】按如图所示装置进行实验。
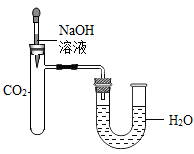
实验前U型管两端液面相平,将NaOH溶液滴入试管中,恢复到室温后,U型管中的液面左高右低。据此,甲同学得出“CO2与NaOH发生了化学反应”的结论。
(2)U型管中液面高度发生变化的原因是_______ 。
(3)上述结论的证据不充足,理由是_____ 。
【实验3】按如图所示装置进行实验。
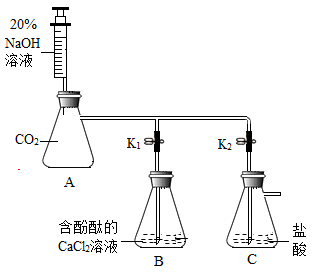
查阅资料:i.CaCl2溶液呈中性;ii.
实验步骤如下:
①检查装置的气密性,往装置中加入药品;
②关闭K1、K2,将注射器中的NaOH溶液缓缓推入A中;
③A中物质充分作用后,打开K1,B中无色溶液倒吸入A中,A中产生沉淀且溶液显红色
④关闭K1,打开K2,将注射器活塞向上拉,C中溶液倒吸入A中。
(4)步骤③“产生沉淀”的现象仍不足以证明CO2与NaOH发生了化学反应,理由是____ 。
(5)步骤④中,若观察到____ (填现象),证明CO2与NaOH发生了化学反应。CO2与NaOH反应的化学方程式为_______ 。
【实验1】配制溶液
(1)用NaOH固体配制20g20%NaOH溶液,无需用到的玻璃仪器有
A 胶头滴管 B 酒精灯 C 量筒 D 烧杯 E 玻璃棒
【实验2】按如图所示装置进行实验。

实验前U型管两端液面相平,将NaOH溶液滴入试管中,恢复到室温后,U型管中的液面左高右低。据此,甲同学得出“CO2与NaOH发生了化学反应”的结论。
(2)U型管中液面高度发生变化的原因是
(3)上述结论的证据不充足,理由是
【实验3】按如图所示装置进行实验。

查阅资料:i.CaCl2溶液呈中性;ii.

实验步骤如下:
①检查装置的气密性,往装置中加入药品;
②关闭K1、K2,将注射器中的NaOH溶液缓缓推入A中;
③A中物质充分作用后,打开K1,B中无色溶液倒吸入A中,A中产生沉淀且溶液显红色
④关闭K1,打开K2,将注射器活塞向上拉,C中溶液倒吸入A中。
(4)步骤③“产生沉淀”的现象仍不足以证明CO2与NaOH发生了化学反应,理由是
(5)步骤④中,若观察到
18.推广车用乙醇汽油,可以减少汽车尾气污染。利用秸秆为原料可生产乙醇(C2H6O),其中包含葡萄糖(C6H12O6)转化为乙醇的反应( )。每生产2.3t乙醇,理论上参加反应的葡萄糖的质量是多少?(写出计算过程)
)。每生产2.3t乙醇,理论上参加反应的葡萄糖的质量是多少?(写出计算过程)
 )。每生产2.3t乙醇,理论上参加反应的葡萄糖的质量是多少?(写出计算过程)
)。每生产2.3t乙醇,理论上参加反应的葡萄糖的质量是多少?(写出计算过程) 搜索
搜索
 难度系数:0.94
难度系数:0.94  答案解析
答案解析
 有奖纠错
有奖纠错
